
4月26日,四川大学华西医院生物治疗国家重点实验室董浩浩研究员与唐晓迪副教授团队,联合浙江大学张兴教授团队和周如鸿教授团队,共同在Nature杂志上发表了题为“Structural basis of BAM-mediated outer membraneβ-barrelprotein assembly”的研究论文。四川大学“华西生物国重创新班”本/硕/博连读研究生沈崇榕、浙江大学常圣海博士、我校博士/博士后罗庆华、浙江大学博士后陈骏为该论文的并列第一作者。此外,该研究还得到了四川大学魏霞蔚教授、朱晓峰教授、逯光文教授和武汉大学董长江教授团队的大力支持。四川大学华西医院生物治疗国家重点实验室/国家老年疾病临床医学研究中心为该论文第一作者单位和通讯作者单位。
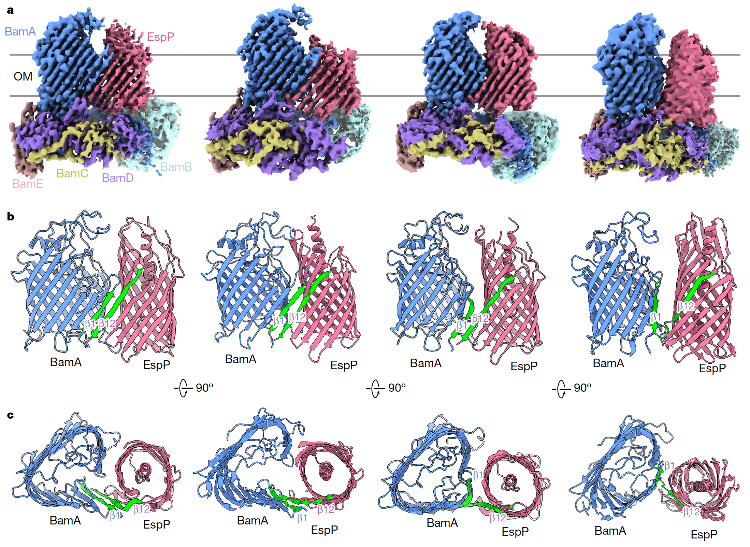
图1. BAM-EspP的四个动态中间态冷冻电镜密度图与结构图
该研究首次捕捉到了BAM与底物b-桶蛋白EspP在外膜折叠整合过程中的多个中间态构象(图1),同时通过体内外功能分析及全原子分子动力学模拟揭示了底物OMP的组装、关闭及释放的全过程,为以此蛋白复合物为靶点的新型抗菌药物研发提供重要科学依据。
临床常见病原菌如铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌等均属于革兰氏阴性菌,其特殊的外膜成分是产生高致病性和高耐药性的关键。β-桶状蛋白(Outer membrane proteins, OMPs)是细菌外膜的主要蛋白成分,作为物质交换门户参与细菌膜稳定维持、宿主入侵与定植以及耐药等功能。b-桶蛋白三级结构的正确折叠是其发挥功能的重要条件:新生肽链在胞内合成后被运送到外膜由外膜b-桶蛋白整合机器(β-barrel assembly machinery,BAM)帮助折叠成桶型结构并整合到外膜中。这一过程在细菌中非常保守,抑制BAM功能可导致细菌死亡,因此被视为最具潜力的新型抗菌靶点。近年,针对BAM结构功能的研究成为结构生物学的一个热点。研究发现BAM蛋白在不消耗能量的情况下,通过核心亚基BamA自身β-桶的侧向打开,利用BamA第一根β-片层与底物OMP的最后一根β-片层(信号肽)相互作用,启动外膜蛋白折叠的动态分子模型。前期的研究揭示了BAM整合底物的初始阶段,而有关BAM如何完成底物b-桶的折叠、关闭及释放的分子机制尚不清楚。
由于BAM在体内组装底物的过程很快,因此捕获BAM整合底物的中间复合物具有极高的挑战性。研究团队通过在BAM与EspP预测的互作区域引入不同位置的半胱氨酸使其在体内自发形成双硫键的策略成功获得BAM-EspP复合体蛋白。该研究团队通过单颗粒冷冻电镜技术首次解析了BAM-EspP的多种构象,包括双桶打开(open state)、预关闭(ready-to-close state)、半关闭(semi-closed state)和全关闭(full-closed state)的四个状态的高分辨率三维结构,展示BAM在组装底物OMP过程中的完整动态变化过程,阐明了BAM对于EspP的识别、整合及释放的工作机制(图1)。
该研究发现BAM的各结构域构象变化参与了诱发底物OMP整合过程中各阶段的启动。在起始阶段,BamA β-桶N端的b1链向外侧向打开,使初始EspP肽链C端作用于该链并作为模版协助折叠整合形成整张b-片层。在预备闭合和半闭合构象中,BamA桶状结构从外开(outward open)状态转变为内开(inward open)至内关(inward closed)状态,该构象变化可通过结合细胞膜张力对相连的底物b-片层施加内卷动力,使其向内弯卷成桶状结构,并利用类似拉链机制在b1与b12之间形成氢键关闭b-桶。与此同时,BamAb-桶的N端从与底物互作的界面逐渐剥离,允许各自b-桶启动关闭程序,直至双桶完全关闭并分离。通过折叠实验显示底物OMPb1与b12之间形成的所有氢键皆对于底物b桶结构的完整折叠与释放十分重要,但对于BamA-b1来说胞内端的氢键更为重要,有助底物识别和启动整个折叠程序。同时,BAM辅助亚基BamB-E与BamA的周质附件(POTRAs)在胞内形成周质环,在b桶关闭过程中,该周质环同时发生顺时针旋转,其中一些处于POTRA域的连接环随着构象改变与BamA-b桶或辅助亚基产生不同相互作用,推断是通过引起b桶N端构象变化,诱发双b桶关闭的启动诱因,从而提出BAM“旋转和闭合”机制,并支持早期提出的“旋转和入膜”的OMP折叠模型。
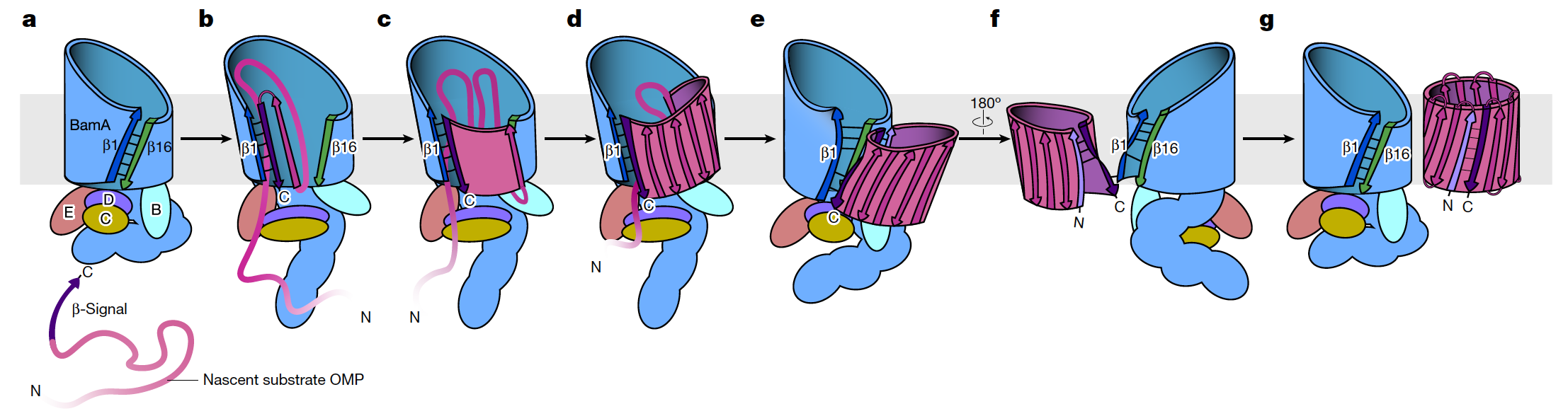
图2.推测BAM装配底物的工作机制示意图
BamA属于OMP85蛋白超家族,参与从细菌外膜到人类线粒体乃至植物叶绿体外膜蛋白的组装,其对于b-桶组装功能在进化上是保守的,这表明这些蛋白具有共同的进化起源和折叠机制。该研究发现不仅为靶向耐药菌干预提供科学依据,同时对于理解真核细胞双膜细胞器线粒体和叶绿体中b-桶蛋白的保守折叠与整合机制具有重要的启发意义。
本研究成果还在Nature同期刊受邀发表了题为:“ Step-by-step assembly of ab-barrel protein in a bacterial membrane”的研究简报(Research Briefing)。本项目工作全部在国内完成,由国家科技部重点研发、国家自然科学基金、中央财政经费、省市级等项目资助完成。
董浩浩,四川大学华西医院生物治疗国家重点实验室、国家老年疾病临床医学研究中心研究员,博士生导师,国家重点研发计划“生物大分子与微生物”青年首席科学家,国家海外高层次青年人才。团队长期致力针对耐药菌的靶点探索及新药研发,在革兰氏阴性菌外膜形成及维稳的研究领域发表了SCI论文25篇,其中包括以第一或通讯作者(含共同)发表的Nature(2014;2016;2023) 3篇,Nature Communications(2017;2019)2篇以及Nature Structural & Molecular Biology(2020; 2021)2篇。相关研究解析了重要功能蛋白质机器的分子机制并揭露重要抗菌靶点,对于推动新抗菌药物研发具有重要科学意义。
原文链接:https://www.nature.com/articles/s41586-023-05988-8